줄기세포 치료제·바이오시밀러 등
혁신 신약들, 승인획득 현재진행형
삼성바이오 ‘SB8’ 올해 허가 전망
셀트리온 ‘램시마SC’ 임상 진행중
“FDA통과, 세계시장 진출 보증서”
제약사들 개발단계부터 승인 목표

올 해도 한국 바이오의 미 식품의약품청(FDA) 도전은 계속될 것으로 보인다. 지난 해 사상 최대 8개 국산 의약품이 FDA 관문을 통과한 것에 만족하지 않은 현재진행형의 모습이다. 특히 올 해 또는 수 년 내 FDA 승인이 예상되는 국산 의약품은 줄기세포 치료제, 바이오시밀러 등 혁신성에 기반을 둔 제품들이어서 FDA 승인 후 미국 시장뿐만 아니라 글로벌 시장에서도 영향력을 발휘할 것으로 기대가 되고 있다.
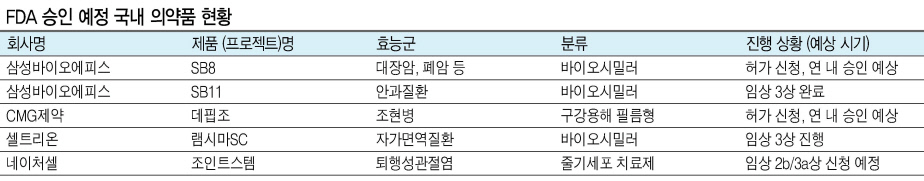
▶바이오시밀러 성공 행보는 ‘진행형’=올 해에도 국산 바이오시밀러의 FDA 허가를 위한 진행은 순조로울 전망이다. 우선 올해 내 FDA 승인이 예상되는 의약품으로는 삼성바이오에피스의 바이오시밀러 ‘SB8’이 있다. SB8은 로슈의 대장암, 폐암 치료제인 ‘아바스틴’의 바이오시밀러로 지난 해 11월 FDA에 승인 신청을 한 상태다.
삼성바이오에피스 관계자는 “통상 FDA 허가를 신청한 뒤 1년 정도의 기간이 소요되는 경험에 비춰 올 해 말 정도 허가가 날 것으로 기대하고 있다”고 말했다.
삼성바이오에피스는 지난 해 1월 온트루잔트, 4월 에티코보, 7월 하드리마까지 총 3개의 바이오시밀러가 FDA 승인을 받는데 성공했다. 올 해에도 SB8에 대한 승인 기대감이 높아지면서 삼성바이오가 개발한 거의 모든 바이오시밀러는 FDA 허가를 획득하는 쾌거를 이루게 된다.
삼성바이오에피스는 SB8에 이어 안과질환 치료제 ‘루센티스’ 바이오시밀러인 ‘SB11’에 대한 미 임상 3상도 완료한 상태다. 임상 3상 데이터를 수집하고 허가를 위한 자료를 정리하고 나면 올 해 내 FDA 승인을 신청할 수 있을 것으로 예상된다.
셀트리온의 바이오시밀러 ‘램시마SC’는 현재 임상 3상을 진행 중이다. 국산 바이오시밀러 중 최초로 FDA 승인을 받은 ‘램시마(정맥주사 제형)’의 피하주사 제형인 램시마SC는 지난 해 4월 FDA로부터 임상 3상 승인을 받았다.
특히 램시마SC는 기존 램시마의 승인과 유럽의약품청(EMA)에 이미 제출한 자료를 바탕으로 미국에서 임상 1상과 2상을 면제 받았다.
셀트리온 관계자는 “램시마SC는 셀트리온이 개발한 세계 최초 항체 바이오시밀러인 램시마의 투약 편의성을 획기적으로 개선했다는 강점이 있다”며 “오리지널 제품인 레미케이드는 정맥주사형 밖에 없어 피하주사형에 대한 수요가 상당할 것으로 예상한다”고 말했다.
▶줄기세포 치료제 ‘조인트스템’ 임상 순조롭게 진행=바이오시밀러와 함께 국내에서 강점을 보이는 줄기세포 치료제도 FDA 허가를 위한 임상을 순조롭게 진행 중이다.
네이처셀의 퇴행성관절염 치료제 ‘조인트스템’은 지난 해 말 FDA와의 미팅을 완료하고 임상 2b 및 3a상에 대한 신청을 2~3월 중에 한다는 계획을 세우고 있다. FDA와의 미팅을 통해 일부 보완할 점을 업데이트 시킨 뒤 임상승인 신청을 준비해 왔다.
지난 해 초 조인트스템은 미국에서 진행한 임상 2상에서 치료 효과와 안전성을 확인했고 이를 토대로 2b상 및 3a상을 위한 준비를 마쳤다.
현재 국내에서는 260명의 환자를 대상으로 임상 3상을 진행 중이다. 줄기세포 치료제는 투여 후 6개월 정도 경과를 관찰하는 과정을 거친다.
네이처셀 관계자는 “올 해 한국 임상 3상과 미국 임상을 진행한 뒤 결과가 좋으면 RMAT(첨단재생의약품에 대한 개발 및 신속 승인 가속화 제도)를 통해 일반 신약에 비해 빨리 품목 허가가 가능해진다”며 “만약 조인트스템이 FDA 승인을 획득하게 되면 미 FDA 관문을 뚫은 첫 번째 줄기세포 치료제가 되는 것”이라고 말했다.
네이처셀 측은 모든 과정이 완료된 뒤 2025년쯤에는 최종 허가를 획득할 것으로 기대하고 있다고 밝혔다.
CMG제약의 조현병 치료제 ‘데핍조’도 혁신성을 기반으로 개발한 신약이다. 데핍조는 기존 경구용 조현병 치료제를 구강붕해필름형으로 만든 의약품이다. 지난 해 말 허가 신청 접수를 완료해 올 하반기부터 시장 출시를 목표로 하고 있다.
CMG제약 관계자는 “조현병과 같은 정신질환 환자들은 증상이 악화될 경우 약을 거부하거나 뱉어내는 경우가 많은데 필름제형의 경우 물 없이 복용이 가능하고 입 안에서 쉽게 녹기 때문에 이런 문제를 해결할 것으로 기대된다”고 말했다.
▶FDA는 선택 아닌 필수…개발 단계부터 FDA 승인 목표로=이처럼 매년 FDA 승인을 획득하는 국산 의약품이 증가하는 이유는 국내사들의 전략적인 접근이 있었기 때문이다.
FDA는 단순히 한 국가의 의약품 허가 기관을 넘어서는 상징성이 있다. FDA 허가를 획득했다는 건 전 세계 의약품 품질에 대한 보증서와 같다. FDA 허가를 받게 되면 유럽을 비롯한 전 세계 대부분 국가에서도 승인 가능성이 높아진다는 것을 의미한다.
업계 관계자는 “FDA가 의약품을 보는 기준은 가장 까다롭다고 알려져 있기 때문에 FDA를 통과했다면 다른 나라 기준도 통과할 수 있다는 의미로 받아 들여진다”며 “시장 자체도 세계에서 가장 큰 규모이기 때문에 이제 국내 제약바이오사들이 첫 개발단계부터 FDA 승인을 염두하고 개발하는 것은 당연한 목표가 됐다”고 말했다.
손인규 기자